La notizia è di quelle che porta ottime speranze. L’AIFA (Agenzia Italiana del Farmaco) ha dato il via libera all’utilizzo del primo anticorpo contro il Covid-19 a prevenzione della malattia nei pazienti fragili.
Uno studio condotto su 5.200 persone ha, infatti, mostrato l’efficacia a lungo termine di Tixagevimab associato a Cilgavimab.
Dalle evidenze raccolte, emerge come Tixagevimab e Cilgavimab – ora disponibili per la profilassi pre-esposizione al virus nei soggetti con sistema immunitario compromesso – inneschino una riduzione dell’83% del rischio di sviluppare la patologia a sei mesi.
Nel concreto stiamo parlando di due anticorpi monoclonali messi a punto con l’obiettivo di prevenire i sintomi del Covid-19, prima dell’esposizione all’agente patogeno, in tutti gli individui ad alta vulnerabilità. Individui in cui il sistema immunitario non funziona a dovere ed è fondamentale la protezione aggiuntiva post-vaccino.
La profilassi pre-esposizione al Covid-19 è oggi un’arma estremamente potente e di grande aiuto in chi è, ad esempio, affetto da leucemia linfatica cronica. Oppure presenta immunodeficienze primitive o acquisite. O, ancora, è sottoposto a trattamenti immunosoppressivi a seguito di un trapianto.
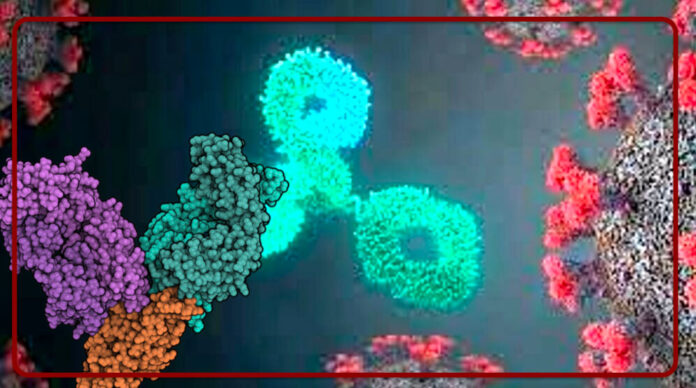
“Un anticorpo monoclonale è un tipo di proteina concepita e progettata per riconoscere e legarsi a una struttura specifica, detta antigene. Tixagemivab e Cilgavimab – dice il professor Giovanni Di Perri, Direttore della Scuola di specializzazione in Malattie infettive dell’Università di Torino e Responsabile della Divisione universitaria di Malattie infettive all’ospedale Amedeo di Savoia – sono stati sviluppati per legarsi a due siti distinti sulla proteina Spike – termine ormai assimilato dall’intera opinione pubblica – di Sars-CoV-2: virus che scatena il Covid-19. Questa combinazione impedisce dunque al virus di entrare nelle cellule del corpo umano e dare il là all’infezione. Proteggere gli individui vulnerabili concorre altresì a prevenire l’evoluzione virale, fattore rilevante nella comparsa delle varianti”.
Concluse le valutazioni da parte dell’AIFA, il Ministero della Salute ha così disposto, a fine gennaio 2022, l’autorizzazione all’impiego in emergenza della combinazione dei due anticorpi negli adulti e negli adolescenti (di età pari o superiore ai 12 anni). Uomini e donne interessati da una compromissione immunitaria compresa tra moderata e grave; nonché in coloro per i quali l’immunizzazione (vaccino) non è raccomandata. In altri termini, chi riceve gli anticorpi non deve risultare infetto o riferire un’esposizione recente con persone con infezione da Sars-CoV-2.
“I due anticorpi – spiega Raffaela Fede, Direttore medico di AstraZeneca Italia – sono derivati da cellule B donate da pazienti convalescenti dopo Sars-CoV-2. Arrivano dal lavoro svolto dagli esperti del Vanderbit University Medical Center (USA). L’analisi dei dati a sei mesi nello studio PROVENT ha dimostrato la riduzione del rischio relativo di contrarre una forma sintomatica della malattia pari all’83%. Occorre però un follow-up maggiore a stabilire la durata complessiva della protezione dall’agente virale; ma potremmo stimarla anche oltre l’anno effettuata una singola somministrazione”.
Le buone notizie non si esauriscono qui. Viste le risultanze di altri tre studi indipendenti, messi in campo dall’University College di Oxford (Regno Unito), dalla Washington University School of Medicine di St. Louis (USA) e dalla FDA (Food and Drug Administration), questa combinazione di anticorpi è in grado di mantenere la sua efficacia nel mandare ko le varianti attualmente conosciute: Omicron compresa.
Marco Valeriani
















